Histoire
de l'évolution du modèle atomique.
De tout temps l'Homme s'est posée la question: mais de quoi
est constituée la matière?
Dès
l'antiquité, les premiers "scientifiques" grecs croyaient que la
matière était constituée de quatre éléments: la terre, l'eau, le feu et
l'air. Cette croyance trouve une explication dans l'observation de la
combustion d'un morceau de bois. Pendant la combustion, il y a
production de fumée (air), de vapeur d'eau (eau) et de cendre (terre).
Cette théorie quoique simple était le résultat d'observations de
philosophes tel que Thalès et Empédocle.
► La théorie atomique la
plus originale de l'époque fût proposée au Ve siècle avant notre ère
par Démocrite. Ce savant philosophe proposa que la matière était
constituée de particules infiniment petites et indivisibles. Toutes
substances étaient faites de ces particules. Entre ces particules
existait un espace vide. La matière était donc discontinue. En grec
ancien le mot atomos signifie indivisible et la théorie de Démocrite a
laissé ses traces jusqu'à nos jours.
Démocrite n'étant pas un
philosophe très populaire en son temps, sa théorie fût
rejetée au
profit d'une théorie de la continuité de la matière proposée par
Aristote .

Au IV siécle avant JC, Aristote s'appuyait sur le
concept des quatre éléments de base de Thalès et affirmait que les
atomos ne pouvaient exister puisque invisibles à ses yeux. La
conception aristotélicienne de la matière reçue l'appui des religieux
de l'époque et traversa les siècles qui suivirent jusqu'au 18e siècle.

Vers
le 15e siècle des savants commencèrent à progresser dans la
connaissance de la matière et a remettre en doutes les concepts
aristotéliciens du monde et de la matière. L'expérimentation et la
présentation devant le roi d'expériences simples devenaient à la mode.
► Robert
Boyle (chimiste anglais du 17e siècle) proposa que la matière était
faite de quelques substances simples appelées éléments.

► Dans les
années 1780, Antoine-Laurent Lavoisier réussit à décomposer l'oxyde de
mercure et énonça la loi de la conservation de la masse. Le fameux
:"rien ne se perd, rien ne se crée".

Avec ces scientifiques
commençait un nouvel âge pour la science, plus axé sur la recherche et
l'expérimentation. ET enfin une proposition sérieuse d'un nouveau
modèle atomique.
► Dalton chimiste et physicien britannique développa la théorie
atomique sur laquelle fut fondée la science physique moderne.
Vers 1800 Dalton avance la théorie selon laquelle la matière est
composée d'atomes indivisibles

Voici les axiomes importants de la théorie de Dalton :
La matière est composée de particules invisibles, indivisibles,
massiques appelées atomes
Les atomes d'un élément donné sont identiques.
► Le premier modèle de l'atome : Le modèle
du pain aux raisins.
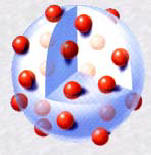
Thomson est à l'origine de la découverte de l'électron par ses
expérimentations sur les flux de particules (électrons) créés par des
rayons cathodiques.Théoricien et expérimentateur, Thomson avança en
1898 la théorie du «pain aux raisins» sur la structure atomique, dans
laquelle les électrons sont considérés comme des «raisins» négatifs
enfoncés dans un «pain» de matière positive. On appelle souvent le
modèle de Thomson, modèle du pain aux raisins (ou encore le pudding).
► Le deuxième modèle de l'atome : Le modèle lacunaire.
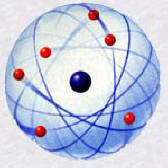
Lord
Rutherford, physicien britannique, il fut lauréat du prix Nobel pour
ses travaux en physique nucléaire et pour sa théorie relative à la
structure de l'atome. En 1911 Rutherford fut le premier à décrire
l'atome comme un noyau dense autour duquel gravitent des électrons.

►Le troisième modèle
de l'atome : Le modèle planétaire.
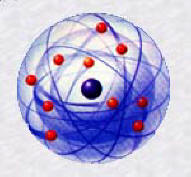
Bohr,
physicien danois, prix Nobel en 1922, pour sa contribution à la
physique nucléaire et à la compréhension de la structure atomique.

La
théorie de Bohr sur la structure atomique, pour laquelle il reçut le
prix Nobel de physique, fut publiée entre 1913 et 1915. Son travail
s'inspira du modèle planétaire de Rutherford, dans lequel l'atome est
considéré comme un noyau compact entouré d'un essaim d'électrons. Le
modèle propose que les électrons qui gravitent autour du noyau sont
situés sur des niveaux d'énergie. Chaque niveau d'énergie ne peut
contenir qu'un nombre maximum d'électron. Ce modèle contribua
énormément aux développements ultérieurs de la physique atomique
théorique. C'est ce modèle qui est encore en vigueur.
► Le dernier modèle de l'atome :
Le modèle quantique.
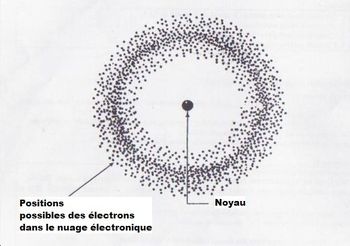
Le
modèle de Bohr est le dernier modèle obéissant à la physique classique,
c'est-à-dire la physique qui explique les mouvements et les phénomènes
existant à notre échelle humaine. Ces modèles d'atomes sont donc
faciles à comprendre et à se représenter.
Quel plaisir intellectuel
(et quelle paresse!) que de se représenter les atomes sous forme de
petites boules tournant les unes autour des autres...
Ce modèle est d'ailleurs
toujours celui que le grand public affectionne!
Eh
bien ce modèle est faux car à l'échelle atomique, de nouvelles lois
s'appliquent! Ces lois appartiennent à une étrange physique très
éloignée de nos concepts courant: la physique quantique.
Adapté de l'encyclopédie
Encarta 97 de Microsoft










