Combustions
complexes
A lire et
à comprendre...
On étudie les combustions de gaz (combustibles) dans le
dioxygène.
L'idée est de retrouver comment les molécules réagissent et se
transforment pour en former d'autres....
Il faut savoir résumer ces transformations chimiques en utilisant
l'écriture du chimiste.
Une seule règle de la nature...
Lors d'une transformation chimique la
conservation des atomes est respectée.
Exemple de ce qu'il faut savoir faire....
Exemple 1 : Combustion du
gaz dihydrogène dans le dioxygène.
Observation :
La combustion du dihydrogène dans le dioxygène produit de
l'eau
On commence par simplifier l'énoncé :
C'est le bilan : molécule(s)
de dihydrogène + molécule(s) de
dioxygène ---> molécule(s) d'eau
Ensuite pour comprendre le mécanisme, on modélise cette transformation
chimique
Modélisation

Dans la nature cette transformation chimique n'est pas possible car un
atome d'oxygène a disparu (2 à gauche mais 1 à droite)
La
conservation des atomes n'est pas respectée..
On en déduit qu'il se forme 2 molécules d'eau...

On avance vers la solution mais la conservation des
atomes n'est
toujours pas respectée..
Il manque 2 atomes d'hydrogène à gauche..
C'est donc 2 molécules de dihydrogène qui réagissent (brûlent) avec 1
seule molécule
de dioxygène..
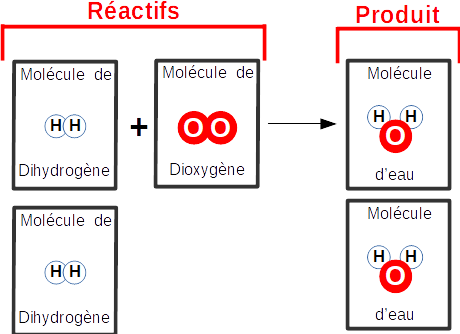
On à trouvé !
On peut maintenat expliquer le déroulement de cette transformation
chimique
Lors de la combustion : 2
molécules de dihydrogène réagissent avec 1
molécule de dioxygène pour produire 2 molécules d'eau
ce qui se résume avec l'écriture du chimiste par :
Equation de réaction :
2H2 + O2 ---> 2H2O
Dans la vie courante on utilise cette transformation chimique pour
fabriquer de l'eau pure mais aussi pour utiliser l'énergie crée par
cette
combustion pour propulser une fusée.

Exemple 2. Combustion complète du
méthane
Le méthane (molécule de formule CH4)
est utilisé dans certaines gazinières.
Etudions la combustion de ce gaz dans le dioxygène.
Bilan :
molécule(s) de méthane + molécule(s) de
dioxygène ---> molécule(s) d'eau + molécule(s) de
dioxyde de carbone
Modélisation
(complète la modélisation pour obéir à la
conservation des
atomes sans regarder la solution plus bas...)
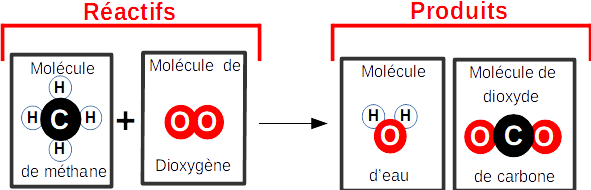
Equation de réaction :
( à compléter)
....CH4 + ....O2
---> ....H2O + ....CO2
Solution :
Modélisation
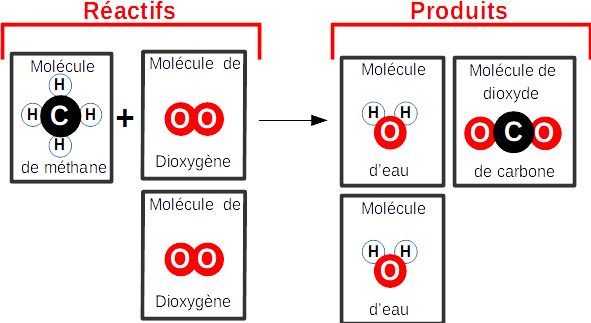
Equation de réaction :
CH4
+ 2O2 ---> 2H2O
+ CO2
Dans la vie courante, on n'utilise pas cette combustion pour produire
de l'eau et du dioxyde de carbone
On utilise la chaleur dégagée par cette transformation
chimique pour cuire des aliments.

Evaluation :
prochain (QCM V.04)
Combustion du propane
dans le dioxygène.
(Le propane (molécule de formule C3H8)
est un autre gaz utilisé dans des
gazinières...)
Bilan :
molécule(s) de propane + molécule(s) de
dioxygène ---> molécule(s) d'eau + molécule(s) de
dioxyde de carbone
Modélisation (à compléter)
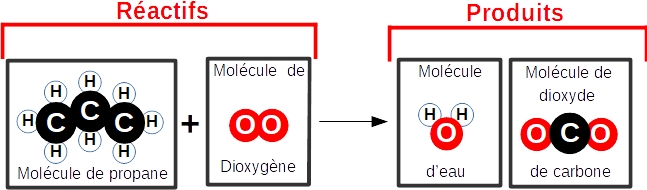
Equation de réaction :
Solution et évaluation de cette transformation chimique en
fin de
semaine par QCM pronote !
Bonne semaine à tous !







